Συζευγμένα Αντισώματα – φάρμακα: τα έξυπνα φάρμακα στη θεραπεία του καρκίνου

Ο Paul Ehrlich αποτέλεσε τον πρώτο επιστήμονα, ο οποίος εισήγαγε τον όρο ‘έξυπνη σφαίρα’ ή καλύτερα ‘έξυπνο βέλος’ (‘magic bullet’), όταν οραματίστηκε ότι η επιλεκτική διασύνδεση μιας ουσίας σε ένα παθογόνο (μικρόβιο ή καρκινικό κύτταρο) δύναται να προκαλέσει στοχευμένη μεταφορά φαρμάκου (τοξίνης ή αντικαρκινικού παράγοντα) στο συγκεκριμένο παθογόνο, και κατά συνέπεια να οδηγήσει στο θάνατο αυτού: εξαιτίας αυτής της ερευνητικής του ιδέας-θεωρίας κέρδισε το βραβείο Nobel Ιατρικής το 1908.
Παρά το γεγονός ότι τα Συζευγμένα Αντισώματα - Φάρμακα (Antibody - Drug Conjugates, ADC’s) ερευνώνται εδώ και μερικές δεκαετίες, οι πρόσφατες εξελίξεις στη μοριακή βιολογία και μοριακή βιοχημεία του Καρκίνου μας έδωσαν τη δυνατότητα μόλις την τελευταία δεκαετία (Panowski και συνεργάτες, 2014) να κατανοήσουμε σε βάθος το θεραπευτικό δυναμικό αυτών των ADC’s, ώστε τελικά να τα εντάξουμε στην καθημερινή φαρμακευτική μας φαρέτρα έναντι πολλών συμπαγών νεοπλασμάτων τα τελευταία χρόνια.
Τα Μονοκλωνικά Αντισώματα (Trastuzumab, Pertuzumab, Cetuximab, Rituximab) έχουν αποδειχθεί όχι απλώς αποτελεσματικά, αλλά ‘standard of care’ στη θεραπεία πληθώρας συγκεκριμένων συμπαγών νεοπλασμάτων και λεμφωμάτων. Από την άλλη πλευρά, η παραδοσιακή Χημειοθεραπεία παραμένει μεν η κύρια αντικαρκινική θεραπεία, επιδεικνύοντας όμως περιορισμένη εκλεκτικότητα έναντι των καρκινικών κυττάρων, αφήνοντας ‘θεραπευτικό παράθυρο’ και μειωμένη αποτελεσματικότητα, μέσω των μηχανισμών αντοχής, αλλά και ανεπιθύμητες ενέργειες από τους υγιείς ιστούς.
Τα ADC’s αποτελούν ουσιαστικά συμπλέγματα αντισωμάτων – αντικαρκινικών φαρμάκων, που συνδέονται μεταξύ τους μέσω ενός συνδέτη (linker, hinge region), ώστε τα μονοκλωνικά αντισώματα με το Fab τμήμα τους και τους τόπους σύνδεσης των αντιγόνων (paratopes, antigen binding sites) να συνδέονται με τους καρκινικούς επίτοπους (Σχήμα 1). Κάθε ADC προκαλεί με τη σύνδεσή του, τον κυτταρικό θάνατο (απόπτωση) του καρκινικού κυττάρου, σε 5 στάδια:
1. Επιλεκτική σύνδεση του συγκεκριμένου αντισώματος - antibody (και άρα ολόκληρου του συμπλέγματος μαζί με το φάρμακο-φονιά, cytotoxic drug) με το αντίστοιχο καρκινικό αντιγόνο, όπως το ‘κλειδί με την κλειδαριά’
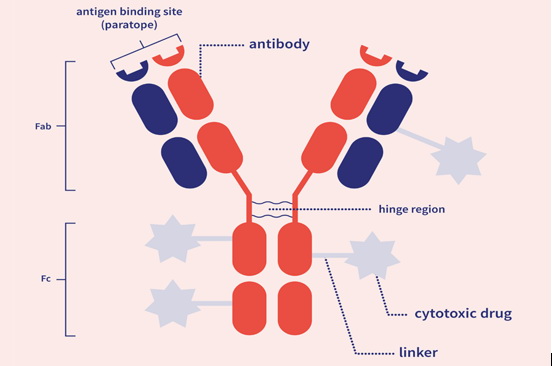
Σχήμα 1. Σύμπλοκο αντισώματος – φαρμάκου (ADC), και τα 5 μέρη αυτού
2. Διαδικασία ‘εσωτερίκευσης΄ του συμπλέγματος μέσα στο εσωτερικό του καρκινικού κυττάρου, με τη διαδικασία της ενδοκυττάρωσης (endocytosis)
3. Διαχωρισμός του αντισώματος από το φάρμακο, μέσω χαλάρωσης του συνδέτη και άλλων ενδοκυττάριων διεργασιών
4. Διαδικασία απελευθέρωσης του κυτταροτοξικού παράγοντα – φαρμάκου στο κυτταρόπλασμα
5. Κυτταρικός θάνατος: τα κυτταροτοξικά φάρμακα μπορούν να προκαλέσουν θάνατο του κυττάρου (απόπτωση), μέσω διαφόρων μηχανισμών, όπως για παράδειγμα αλληλεπίδρασης με το DNA του πυρήνα του κυττάρου ή της αναστολής των μικροσωληνίσκων του κυττάρου ή των ενζύμων, που μεσολαβούν στον κυτταρικό πολλαπλασιασμό.
Υπολογίζεται χονδρικά ότι μόνο το 1% των ADC’s θα βρουν τελικά το δρόμο τους για το εσωτερικό του καρκινικού κυττάρου, αλλά ακόμα και αυτό το μικρό ποσοστό είναι αρκετό και σαφώς πολύ πιο αποτελεσματικό συγκριτικά με την παραδοσιακή αντικαρκινική θεραπεία. Ο παράγοντας εκείνος που παίζει τον πιο ουσιαστικό ρόλο σε όλη αυτή τη διεργασία των ADC’s είναι η επιλογή του κατάλληλου αντιγονικού επιτόπου προκειμένου να αυξηθεί η ενδοκυττάρωση: όσο μεγαλύτερη η συγγένεια (affinity) μεταξύ αντιγόνων και αντισωμάτων, τόσο μεγαλύτερη και η ‘εσωτερίκευση’ των ADC’s μέσα στα καρκινικά κύτταρα και άρα αποτελεσματικότερος και γρηγορότερος ο κυτταρικός θάνατος.
Παρά τα αποδεδειγμένα πλεονεκτήματα αυτών των «έξυπνων φαρμάκων» υπάρχουν αρκετά δυσεπίλυτα προβλήματα – προκλήσεις, όπως εξάλλου συμβαίνει και με τα κλασικά κυτταροτοξικά φάρμακα:
το πρώτο είναι η λεγόμενη ‘off-target toxicity’, δηλαδή η τοξικότητα και οι ανεπιθύμητες ενέργειες από τους υγιείς ιστούς, οι οποίες παρά το ότι είναι ποσοτικά και ποιοτικά λιγότερες συγκριτικά με εκείνες της χημειοθεραπείας, συνεχίζουν να υφίστανται δεδομένου ότι μικρά κυτταροτοξικά μόρια συνεχίζουν να εκλύονται και να εισέρχονται στην αιματική ροή και άρα να στοχοποιούν και υγιή κύτταρα του οργανισμού.
Το δεύτερο αποτελεί η ανάπτυξη αντοχής των καρκινικών κυττάρων, φαινόμενο επίσης συχνό και με τα παραδοσιακά χημειοθεραπευτικά, που μειώνει όμως τελικά το κλινικό όφελος και την αποτελεσματικότητα των ADC’s. Προτείνεται παγκοσμίως προκειμένου να υπερκεραστεί το φαινόμενο αυτό της αντοχής, η καταλληλότερη επιλογή ή αλλαγή/αντικατάσταση του μορίου – συνδέτη (linker) του φαρμάκου με το αντίσωμα.